Caro estudante esta é a segunda
vez em 2014, que você fará uma avaliação diretamente na internet, portanto siga
exatamente as instruções:
ATIVIDADE EM EQUIPE DE ATÉ 3 ALUNOS
1.
Todas as respostas
devem ser postadas como comentário, na atividade referente a sua série;
2.
Antes de responder
a questão com o comentário no blog, busque as informações na internet e em seu
caderno, construindo uma resposta, escreva uma pré resposta em um rascunho no
caderno, para em casos de queda de energia ou outro problema, a sua equipe não
seja prejudicada
3.
No espaço para
postagem, primeiro digite o nome dos alunos que compõem a equipe, depois a sua
turma e indique o (s) número (s) da (s) questão (ões) que está (ão) sendo
respondida (s);
4.
O comentário
quando postado informa ao professor a data e a hora, portanto não deixe para
fazer em casa pois seu comentário será excluído e sua nota não será computada;
5.
Ao final, antes de
postar comentário, o blog solicitará para você escolher uma forma, escolha
sempre a opção Nome/URL - digitando apenas os nomes dos componentes da equipe,
a URL deve ser deixada em branco;
6.
BOM TRABALHO A
TODOS!
1 1.
Observe as imagens abaixo e procure descobrir por que as cores das
chamas são diferentes? Justifique.

2. Existe alguma relação entre as cores das chamas e o colorido dos
fogos de artifício?
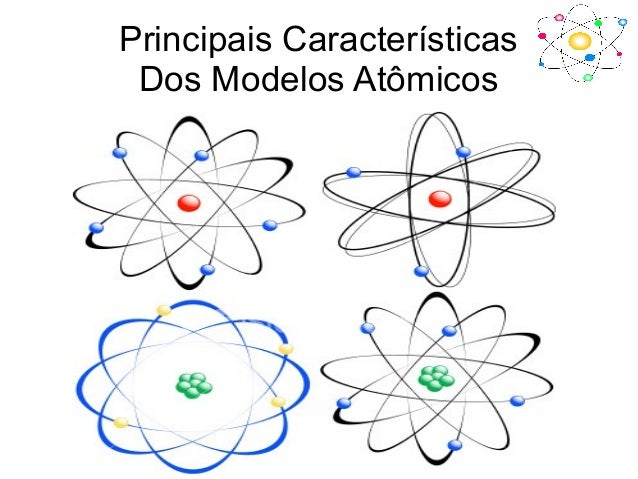
3. Quais foram os principais modelos atômicos desenvolvidos durante os
séculos de pesquisa? Qual a importância das pesquisas para nosso cotidiano.



 PROFESSOR DIEGO FABIANO MARCON
PROFESSOR DIEGO FABIANO MARCON






78 comentários:
j9gehugndifigjhppppppppppppppppadspfjoisdjgpdszfoijgzrsgjpõrgvsfiouehfiehfpiehf\wghi\wghsfxcbv\srigh\sdbn\v\siorgf\srg
1. Porque a cor do fogo depende da temperatura em que ele queima e, gerelmente, cada parte da chama tem uma temperatura diferente. Acor do fogo, na verdade, é resultado da cor da luz que ele emite. Essa luz é formada por particulas muito pequenas que nse comportam como uma onda eletromagnética dependendo do comprimento dessa onda, ela terá uma coloração diferente.
2. Este efeito se deve a queima de diferentes elementos químicos.
3.No século XIX, um cientista chamado John Dalton propôs um modelo de representação do átomo com base nas ideias da altura.Dalton caracterizou o átomo como sendo esférico, indivisível e indestrutível.
Um cientista de nome Joseph Thomson realizou, no final do século XIX, uma série de experiências tirar novas conclusões sobre a cosntituição de um átomo.Thomson concluiu que o átomo não era apenas uma esfera indivisível como tinha dito Dalton. Esta esfera tinha carga positiva e no seu interior existiam partículas com carga eléctrica negativa, a que se dá o nome de electrões.
No início do século XX, um cientista de nome Ernest Rutherford propôs um novo modelo de representação do átomo, com base em novos estudos por ele realizados.a maior parte do átomo era espaço vazio;
na região central do átomo, a que chamou núcleo, concentra-se toda a massa do átomo;
o núcleo tem carga positiva;
os eletrons giram em torno do núcleo, tal como os planetas em torno do Sol.
Niels Bohr, um cientista dinamarquês que já tinha trabalhado com Ernest Rutherford, completou em 1913, o Modelo Atómico de Rutherford.os eletrons se movem em torno do núcleo com órbitas circulares;
a cada órbita corresponde uma determinada energia;
os eletrons com mais energia movem-se em órbitas mais afastadas do núcleo.
O modelo atómico tido como o mais correcto, com base nos conhecimentos que hoje temos, é o Modelo da Nuvem Electrónica.os eletrons não têm órbitas bem definidas, possuem antes movimentos aleatórios em torno do núcleo do átomo;
na nuvem electrónica, há eletrons que se encontram preferencialmente mais próximos do núcleo e outros que se encontram preferencialmente mais afastados;
o núcleo é muito pequeno quando comparado com o tamanho da nuvem electrónica. É possível por isso concluir que a maior parte do átomo é espaço vazio.
1º ano 02
1- Porque a cor do fogo depende da temperatura em que ele queima e, geralmente, cada parte da chama tem uma temperatura diferente. É que a cor do fogo na verdade é resultado da cor da luz que ela emite.
2- Sim. Este efeito se deve a queima de diferentes elementos químicos.
1. porque depende dos matérias colocados no fogo, como por exemplo o cobre e o potássio isso vão dar cores diferentes. e também depende da temperatura em que ele queima. a cor do fogo na verdade é resultado da cor da luz que ele emite, essa luz é formada por fótons, partículas muito pequena que se comportam como uma onda eletromagnética.
2. A temperatura depende da constituição química e da quantidade de material que está sendo queimado, mas não tem relação com a cor. Por exemplo, nas substâncias formadas por hidrocarbonetos (carbono e hidrogênio), quanto maior a cadeia de átomos mais quente será a labareda.
3.Em 1808, John Dalton, um professor inglês, propôs a idéia de que as propriedades da matéria podem ser explicadas em termos de comportamento de partículas finitas, unitárias. Dalton acreditou que o átomo seria a partícula elementar, a menor unidade de matéria.
Surgiu assim o modelo de Dalton: átomos vistos como esferas minúsculas, rígidas e indestrutíveis. Todos os átomos de um elemento são idênticos.
Em 1911, Lord Rutherford e colaboradores (Geiger e Marsden) bombardearam uma lâmina metálica delgada com um feixe de partículas alfa atravessava a lâmina metálica sem sofrer desvio na sua trajetória (para cada 10.000 partículas alfa que atravessam sem desviar, uma era desviada).
Para explicar a experiência, Rutherford concluiu que o átomo não era uma bolinha maciça.
modelo de rutheford Por esse modelo, os átomos seriam compostos por uma esfera minúscula, de carga positiva, rondada por elétrons que descreviam uma trajetória perfeitamente curvilínea ao redor do núcleo. Essas trajetórias seriam 7 e quanto mais afastados, ou seja, quanto mais externas fossem as camadas, mais energético seria o elétron. Este elétron poderia realizar saltos quânticos, ou seja, passar de uma camada para outra mais externa, por absorção de energia e retornar à sua camada original, por emissão do excesso de energia, geralmente sob forma de luz.
ALUNOS: IGOR, MARCELO E RICARDO.
SERIE: 1 ANO 2
1- A composição dos gases que se desprendem, assim como a sua temperatura e disponibilidade do comburente, determinam a cor da chama. No caso da combustão de madeira ou papel a chama é roxa, amarela ou alaranjada. Na queima de gases de hidrocarbonetos obtem-se uma chama azulada, e cores exóticas são obtidas quado são queimadas substâncias que contém elementos metálicos.As chamas também adquirem cores de acordo com a sua temperatura.
2-Os fogos de artifício exibem cores diferentes por causa da queima de diferentes elementos químicos.
3-Modelo atômico de Demócrito (450 a.C.),modelo atômico de Dalton (1808),modelo atômico de Thomson (1807)modelo atômico de Rutherford (1911),modelo atômico de Bohr (1913),modelo atômico de Summerfeld (1916),modelo de Schrödinger (1926).Através delas podemos saber que todas as substâncias,matéria são formadas de átomos
1- As chamas adquirem cores de acordo com a sua temperatura. O poder calórico do material queimado é que determina a temperatura da chama. Por exemplo; As chamas azuis são as mais quentes e as amarelas são as mais frias.
2- Sim. Cada íon existente na composição das substâncias utilizadas ou formadas na combustão da pólvora emite uma luz com uma cor característica, quando submetidos à ação de uma chama.
Por exemplo; O ferro fica dourada, Alumínio fica branco e Cobre fica verde.
3- Ao longo dos tempos, foram surgindo diferentes modelos para explicar a forma e constituição de um átomo. À medida que a ciência progride, também progride a visão que o Homem tem do átomo, surgindo novos modelos que tentam explicar a sua constituição.
Exemplos; Modelo Atómico de Dalton, Modelo Atómico de Thomson, Modelo Atómico de Rutherford, Modelo da Nuvem Electrónica.
Para entender melhor como as coisas funcionam, por exemplo: A queima de materiais.
1º 05
1- Cada um desses elementos químicos liberam uma radiação em que um comprimento de onda é correspondente a característica de cada substância (a cor), então o olho humano é capaz de ver por cores diferentes, podemos perceber que existem certos elementos pela cor característica que fazem quando são aquecidos.
Agrolandia,25 de agosto de 2014
Alunos: Vitor Cardoso de moraes ,sebastião ,lucas pablo bauer
1 As chamas adquirem cores de acordo com a sua temperatura. O poder calórico (PC) do material queimado é que determina a temperatura da chama. As chamas azuis são as mais quentes e as amarelas são as mais frias. A cor depende basicamente do elemento químico em maior abundância no material que está sendo queimado. A mais comum, vista em incêndios e em simples velas, é a chama amarelada, resultado da combustão do sódio que emite luz amarela quando aquecido a altas temperaturas. “Vemos com mais freqüência esse tipo de labareda porque o sódio é o elemento químico mais comum nas atividades humanas”, explica o químico Atílio Vanin, da Universidade de São Paulo. Muitas vezes a base da chama é azul por causa da falta de oxigênio nessa região, que induz à formação de monóxido de carbono. Quando, durante a combustão, são liberados átomos de cobre ou bário, como em incêndios de fiação elétrica, a cor da chama fica esverdeada.
2 Sim existe sim , os elementos das chamas são usados para faze os fogos de artifício,por exemplo o potássio e usado para fazer o azul púrpura ,o Estrôncio para fazer o fogo de artifício vermelho.
Nos fogos de artifício há um pavio que, ao ser acendido, inicia a combustão, fornecendo assim energia para os átomos de determinado elemento químico. Desse modo, o elétron “salta” de um nível de menor energia para um de nível superior. Este efeito se deve à queima de diferentes elementos químicos
3-450 a .c. - Modelo atômico de Demócrito.
1808 – Modelo atômico de Dalton.
1807 – Modelo atômico Thomson.
1911 – Modelo atômico de Rutherford.
1913 – Modelo atômico de Bohr.
1916 – Modelo atômico de Sommerfeld.
1926 – Modelo de Schrödinger
2008 – Evolução do modelo de átomo atual. Continuação ...
1-Os átomos são compostos por prótons e nêutrons que se encontram no núcleo e os elétrons em órbita ao redor do núcleo.
Quando estes elétrons recebem energia passam de um subnível para o outro (de um menos energético para um mais energético) ao voltar para o subnível menos enérgico (pois os átomos tendem a "manter os elétrons mais próximos o possível do núcleo") eles emitem fótons que são os responsáveis pelas cores. Estas cores são diferentes de acordo com a frequência de onda dos fótons.
Agora os elementos exibem cores varidas ao serem expostos ao teste da chama pois digamos: quando submetidos ao calor do fogo, eles recebem energia e ao voltarem devolvem esta energia, as cores são variadas pois depende da quantidade de energia máxima que os elétrons podem absorver ao passar de um subnível para o outro.
2- Não existe,as cores produzidas em fogos de artificio são produzidas a partir de dois fenômenos a incandescência e a luminescência.
3- Inicialmente o átomo foi considerado como uma partícula maciça e indivisível ,porém, com o passar do tempo novas pesquisas revelaram que o átomo não era indivisível. Foi então que,a partir de novas experiência ,surgiram novos modelos atômicos
1-Os átomos são compostos por prótons e nêutrons que se encontram no núcleo e os elétrons em órbita ao redor do núcleo.
Quando estes elétrons recebem energia passam de um subnível para o outro (de um menos energético para um mais energético) ao voltar para o subnível menos enérgico (pois os átomos tendem a "manter os elétrons mais próximos o possível do núcleo") eles emitem fótons que são os responsáveis pelas cores. Estas cores são diferentes de acordo com a frequência de onda dos fótons.
Agora os elementos exibem cores varidas ao serem expostos ao teste da chama pois digamos: quando submetidos ao calor do fogo, eles recebem energia e ao voltarem devolvem esta energia, as cores são variadas pois depende da quantidade de energia máxima que os elétrons podem absorver ao passar de um subnível para o outro.
2- Não existe,as cores produzidas em fogos de artificio são produzidas a partir de dois fenômenos a incandescência e a luminescência.
3- Inicialmente o átomo foi considerado como uma partícula maciça e indivisível ,porém, com o passar do tempo novas pesquisas revelaram que o átomo não era indivisível. Foi então que,a partir de novas experiência ,surgiram novos modelos atômicos
1-Os átomos são compostos por prótons e nêutrons que se encontram no núcleo e os elétrons em órbita ao redor do núcleo.
Quando estes elétrons recebem energia passam de um subnível para o outro (de um menos energético para um mais energético) ao voltar para o subnível menos enérgico (pois os átomos tendem a "manter os elétrons mais próximos o possível do núcleo") eles emitem fótons que são os responsáveis pelas cores. Estas cores são diferentes de acordo com a frequência de onda dos fótons.
Agora os elementos exibem cores varidas ao serem expostos ao teste da chama pois digamos: quando submetidos ao calor do fogo, eles recebem energia e ao voltarem devolvem esta energia, as cores são variadas pois depende da quantidade de energia máxima que os elétrons podem absorver ao passar de um subnível para o outro.
2- Não existe,as cores produzidas em fogos de artificio são produzidas a partir de dois fenômenos a incandescência e a luminescência.
3- Inicialmente o átomo foi considerado como uma partícula maciça e indivisível ,porém, com o passar do tempo novas pesquisas revelaram que o átomo não era indivisível. Foi então que,a partir de novas experiência ,surgiram novos modelos atômicos
1-Os átomos são compostos por prótons e nêutrons que se encontram no núcleo e os elétrons em órbita ao redor do núcleo.
Quando estes elétrons recebem energia passam de um subnível para o outro (de um menos energético para um mais energético) ao voltar para o subnível menos enérgico (pois os átomos tendem a "manter os elétrons mais próximos o possível do núcleo") eles emitem fótons que são os responsáveis pelas cores. Estas cores são diferentes de acordo com a frequência de onda dos fótons.
Agora os elementos exibem cores varidas ao serem expostos ao teste da chama pois digamos: quando submetidos ao calor do fogo, eles recebem energia e ao voltarem devolvem esta energia, as cores são variadas pois depende da quantidade de energia máxima que os elétrons podem absorver ao passar de um subnível para o outro.
2- Não existe,as cores produzidas em fogos de artificio são produzidas a partir de dois fenômenos a incandescência e a luminescência.
3- Inicialmente o átomo foi considerado como uma partícula maciça e indivisível ,porém, com o passar do tempo novas pesquisas revelaram que o átomo não era indivisível. Foi então que,a partir de novas experiência ,surgiram novos modelos atômicos
1-por que cada chama tem um elemento químico diferente que faz sua coloração ser diferente.
2-sim deve ter algum tipo de mistura de elementos que fazem ficar junto mas cem misturar uma com a outra fazendo os elementos quando explodido terem cores diferentes
3-modelo atomíco de Daltom
modelo atomico de tonson
modelo atomico de ruthford
modelo atomico de bohr
1-quando o composto a ser estudado e submetido ao calor, em uma chama, os ions presentes nos sais começaram a emitir luz.Baseado no espectro de emissao do elemento, o composto ira modificar a cor da chama para uma cor caracteristica.
2-este efeito se deve a queima de diferentes elementos quimicos.Cada ion existente na composiçao das substancias utilizadas ou formadas na combustao da polvora emite uma luz com uma cor caracteristica, quando submetidos a açao de uma chama. Ex: arsenio=azul sodio=amarelo
3- Modelo atômico de Dalton= “Toda matéria é formada por átomos, que sãopartículas maciças, esféricas e indivisíveis, eum átomo de um elemento se diferencia dooutro somente pela mudança nos tamanhos enas massas.”
Modelo atômico de Thomson=O átomo é uma esfera de carga elétricapositiva, não maciça, incrustada de elétrons(negativos), de modo que sua carga elétricatotal é nula”.
Modelo atômico de Rutherford=O átomo é constituído de duas regiõesdistintas: um núcleo ou região central quecontém praticamente toda a massa do átomo eapresenta carga positiva; e uma eletrosfera,isto é, uma região ao redor do núcleo, onde oselétrons giram em órbitas circulares”.
Respostas:
1- As cores diferentes dependem basicamente do elemento químico que está em maior abundância no material queimado, como são 6 elementos diferentes, são também 6 cores distintas.
2-Sim, as cores diferentes vem da queima de vários elementos químicos, cada íon presente na composição das substâncias formadas da pólvora em combustão emite luz de cores características.
3-Os principais modelos atômicos eram: Modelo Atómico de Dalton - Modelo Atómico de Thomson - Modelo Atómico de Rutherford -Modelo Atómico de Bohr - Modelo da Nuvem Electrónica. As pesquisas nos ajudam a entender e compreender mais sobre átomos, sobre a unidade básica da matéria, sobre o que somos formados.
1: As cores são diferentes pelo fato de cada chama ter o sal diferente.
2: Sim, pelo fato, que os fogos possuem pólvora, e sais minerai, que quando detona, produzem cores diferentes.
3: Rutherford: modelo do sistema solar.
Thanson: modelo de pudim de passas.
Dautom: modelo da bola de gude.
para compreender tudo que esta em nosso meio, e para vermos o quanto é importante os modelos atomicos.
A cor do fogo , na verdade e resultado da cor que ele emite. essa luz e formada por fotons, partículas muito pequenas que se comportam como uma onda eletromagnética
2 Os fogos de artifícios este efeito se deve a queima de diferentes elementos químicos cada éon existe uma composição das substâncias utilizadas ou formadas na combustão da pólvora emite uma luz com cor característica quando submetido a a uma açao de uma camera
Questão 2: Este fenômeno, a luminescência, pode ser explicado da seguinte forma: um átomo, de um elemento químico qualquer, possui elétrons em níveis de energia. Ao receber energia, estes elétrons são excitados, ou seja, são promovidos a níveis de energia mais elevados. A quantidade de energia absorvida por um elétron é quantizada, ou melhor, é sempre em quantidades precisas, não podendo ser acumulada. O elétron excitado tem a tendência de voltar para o nível menos energético, pois é mais estável. Quando ocorre esta passagem, do nível mais energético para o menos, ocorre também a liberação da energia absorvida, só que agora, na forma de um fóton, ou seja, na forma de luz.
Questão 1: a diferença é que cada cor depende do elemento químico em maior abundância no material que se ta sendo queimado.
Questão 1: Porque cada componente é um sal e contém produtos químicos diferentes, por isso cada sal libera uma cor de chama diferente, liberada pelos fótons durante a queima de cada um dos sais.
1- Ao fornecermos energia a um elétron,este salta de sua órbita para,órbita mais externa ao retornar para sua órbita de origem,emite energia na forma de luz. 2-quando sujeitos a elevadas temperaturas vêem os seus íons metálicos que as constituem passarem do estado fundamental a Estados excitados,com os superior emissão de radiações de cor características sob a forma de uma chama colorida,isso explica diferentes cores dos fogos de artifícios. 3-Modelo atômicos de Demócrito, John Dalton, Thomson, Rutherford, Bohr. Trouxe através do estudo do átomo,novos materiais e medicamentos foram criados,a qualidade de vida das pessoas foi melhorada embora existem problemas a serem enfrentados.
1- Ao fornecermos energia a um elétron,este salta de sua órbita para,órbita mais externa ao retornar para sua órbita de origem,emite energia na forma de luz. 2-quando sujeitos a elevadas temperaturas vêem os seus íons metálicos que as constituem passarem do estado fundamental a Estados excitados,com os superior emissão de radiações de cor características sob a forma de uma chama colorida,isso explica diferentes cores dos fogos de artifícios. 3-Modelo atômicos de Demócrito, John Dalton, Thomson, Rutherford, Bohr. Trouxe através do estudo do átomo,novos materiais e medicamentos foram criados,a qualidade de vida das pessoas foi melhorada embora existem problemas a serem enfrentados.
Continuição do trabalho.
3- Explicação sobre os modelos atômicos
Modelo Atómico de Dalton:
Dalton caracterizou o átomo como sendo esférico, indivisível e indestrutível.
Modelo Atómico de Thomson:
Thomson concluiu que o átomo não era apenas uma esfera indivisível como tinha dito Dalton. Esta esfera tinha carga positiva e no seu interior existiam partículas com carga eléctrica negativa, a que se dá o nome de electrões.
Modelo Atómico de Rutherford:
Após diversas experiências, Rutherfor concluiu que:
a maior parte do átomo era espaço vazio;
na região central do átomo, a que chamou núcleo, concentra-se toda a massa do átomo;
o núcleo tem carga positiva;
os electrões giram em torno do núcleo, tal como os planetas em torno do Sol.Após diversas experiências, Rutherfor concluiu que:
a maior parte do átomo era espaço vazio;
na região central do átomo, a que chamou núcleo, concentra-se toda a massa do átomo;
o núcleo tem carga positiva;
os electrões giram em torno do núcleo, tal como os planetas em torno do Sol.
Modelo Atómico de Bohr:
Bohr concluiu que:
os electrões se movem em torno do núcleo com órbitas circulares;
a cada órbita corresponde uma determinada energia;
os electrões com mais energia movem-se em órbitas mais afastadas do núcleo.
Modelo da Nuvem Electrónica:
Este modelo diz que:
a zona central do átomo, a que se dá o nome de núcleo, é constituida por protões (partículas com carga positiva) e neutrões (partículas com carga neutra);
à volta do núcleo do átomo giram os electrões;
os electrões não têm órbitas bem definidas, possuem antes movimentos aleatórios em torno do núcleo do átomo;
na nuvem electrónica, há electrões que se encontram preferencialmente mais próximos do núcleo e outros que se encontram preferencialmente mais afastados;
o núcleo é muito pequeno quando comparado com o tamanho da nuvem electrónica. É possível por isso concluir que a maior parte do átomo é espaço vazio.
Alunos: Tainá Schaffer , Tairy Kauani Esser Rosa e Cristina Matteussi Bonatti.
1º ano 02.
1- Pois depende do elemento queimado. A coloração depende dos elementos usados em combustão incompleta e completa. E porque depende da temperatura que ela queima. Também depende da gravidade porque em certos momentos o oxigênio e o gás carbônico se espalham uniformemente em todas as direções.
2- Sim , porque os fabricantes misturam a pólvora e sais de diferentes elementos para que, quando detonados , produzem cores diferentes.
Fogo é uma mistura de gases a altas temperaturas, formada em reação exotérmica de oxidação, que emite radiação eletromagnética nas faixas do infravermelho e do visível.
3- 450 a.c- Modelo atômico de Demócrito , 1808-Modelo atômico de Dalton, 1807-Modelo Atômico de Thonson, 1911-Modelo atômico de Rutherford, 1913- Modelo Modelo atômico de Bohr, 1916-Modelo atômico de Sommerrfeld , 1926-modelo atômico de Schrodinger ou modelo atual, 2008- evolução do modelo atômico atual. Todos são importantes para o futuro profissional de química o conhecimento dos modelos atômicos criados pelo homem do decorrer da historia da química para podermos compreender a evolução desda ciência com melhor clareza e profundidade.
1- A coloração da chama provocada pela volatilização e correspondente a transições eletrônicas de determinado elemento químico presentes na amostra em estudo (em especial na forma iônica) é um exemplo de analise por via seca. esta cor da chama é característica de cada elemento.
2- Como cada elemento químico possui órbitas com níveis de energia com valores diferenciados fóton de energia emitido será diferente para cada um. Por isso, cada elemento químico emitira uma cor característica. Desse modo, se for utilizado, por exemplo, oxalato de estrôncio ou nitrato de estrôncio, será fornecido um íon e dará a cor vermelha, ou se for usado cloreto ou nitrato de cobre será produzido o ins e fornecerá a cor verde ou azul.
3- Modelo atômico de Dalton: Em 1808, John Dalton, um professor inglês, propôs a idéia de que as propriedades da matéria podem ser explicadas em termos de comportamento de partículas finitas, unitárias. Dalton acreditou que o átomo seria a partícula elementar, a menor unidade de matéria.
Surgiu assim o modelo de Dalton: átomos vistos como esferas minúsculas, rígidas e indestrutíveis. Todos os átomos de um elemento são idênticos.
Modelo atômico de Thompson: Neste modelo, o átomo é composto de elétrons embebidos numa sopa de carga positiva, como as passas num pudim. Acreditava-se que os elétrons distribuíam-se uniformemente no átomo.
Modelo atômico de Rutherford-Bohr: Por esse modelo, os átomos seriam compostos por uma esfera minúscula, de carga positiva, rondada por elétrons que descreviam uma trajetória perfeitamente curvilínea ao redor do núcleo. Este elétron poderia realizar saltos quânticos, ou seja, passar de uma camada para outra mais externa, por absorção de energia e retornar à sua camada original, por emissão do excesso de energia, geralmente sob forma de luz.
A importância da pesquisa é nos informar cada vez mais sobre um certo assunto, nos fazendo descobrir curiosidades.
01- A cor depende basicamente do elemento químico em maior abundância do material que está sendo queimado.
02- Sim. Para deixar os fogos de artifício coloridos os fabricantes misturam a pólvora, sais de diferentes elementos, para que, quando detonados possam produzir cores diversificadas.
Laranja: Os sais de cálcio são responsáveis por esta coloração de foguetes.
Vermelho: A cor rubra surge do químico de sais de Estrôncio ou Carbonato de Lítio.
Amarelo: Obtido pela queima de Sódio.
Prata: O espetáculo da "Chuva de Prata" é produzida pela queima de pó de titânio, de alumínio ou magnésio.
Dourado: O metal ferro presente nos fogos de artifício confere o tom de Ouro.
Azul: O aquecimento do metal Cobre nos faz visualizar a cor azul.
Roxo: A mistura de Estrôncio e Cobre dá origens a essa cor.
Verde: A queima de Bário faz surgir o verde incandescente.
3-John Dalton
O professor da universidade inglesa New College de Manchester, John Dalton foi o criador da primeira teoria atômica moderna na passagem do século XVIII para o século XIX.
Joseph John Thomson
Em 1898, Joseph John Thomson formulou a teoria segundo a qual a matéria, independente de suas propriedades, contém partículas de massa muito menores que o átomo do hidrogênio. Inicialmente denominou-as de corpúsculos, depois conhecidas como elétrons e acreditava que era impossível auto-dividir as partes sem que ocorra um serramento de fissão nuclear no átomo.
Ernest Rutherford
As bases para o desenvolvimento da física nuclear foram lançadas por Ernest Rutherford ao desenvolver sua teoria sobre a estrutura atômica. O cientista estudou por três anos o comportamento dos feixes de partículas ou raios X, além da emissão de radioatividade pelo elemento Urânio.
Niels Bohr
A teoria orbital de Rutherford encontrou uma dificuldade teórica resolvida por Niels Bohr.
No momento em que temos uma carga elétrica negativa composta pelos elétrons girando ao redor de um núcleo de carga positiva, este movimento gera uma perda de energia devido a emissão de radiação constante. Num dado momento, os elétrons vão se aproximar do núcleo num movimento em espiral e cair sobre si.
1-A cor depende basicamente do elemento químico em maior quantidade na matéria queimada, cada elemento quando entra em combustão tem uma cor especifica, dai 6 elementos atados dão origem as 6 cores diferentes.
2-Esse efeito se deve a queima de diferentes elementos químicos. Cada íon existente na composição da substancias utilizadas ou formadas na combustão da pólvora emite uma luz com uma cor característica, quando submetidos a ação de uma chama.
3-Modelo atômico de Dalton: As reações químicas podem ser deduzidas com base na readaptação dos átomos, como diz a lei de Lavoisler.
Modelo atômico de Thompson: Ele descobriu que existia partículas negativas menores que os átomos e os elétrons.
Modelo atômico de Rutherford: Ele demonstrou que a maior parte do espaço era totalmente vazio e a carga positiva estava toda localizada no núcleo.
Modelo de Bohr: Ele demonstrou alterações ao modelo de Rutherford, os elétrons só podem ocupar níveis de energia bem mais definidas.
A importância é que nos ajuda compreender o que é um átomo, a unidade básica da matéria que é do que somos formados.
01- A cor depende do elemento químico, do que está em maior quantidade, no material que está sendo queimado.
As vezes, a base da chama é azul porque falta oxigênio na região. Em incêndios de fiação elétrica, a chama ganha um tom de verde. As madeiras das árvores, emitem potássio, por isso em queimadas, a chama é vem um tom de violeta.
02- Existe, em alguns fogos de artifício, a liberação de cálcio emite um vermelho vivo. Já outros emitem outras cores, que variam do elemento composto dentro dele, como sódio, boro, lítio, todos emitindo cores diferenciadas.
03-Modelo Atômico de Dalton: Durante muito tempo, pensavam que um átomo tinha forma esférica, e que eram indivisíveis. Mas, no século XIX (19), o cientista John Dalton, propôs um modelo com base no átomo que era imaginado, com características esféricas, era indivisível e indestrutível.
Modelo Atômico de Thomson: No final do século XIX, Joseph Thonson realizou novas experiências para a conclusão de como era um átomo. Ele concluiu que, além de uma esfera indivisível, mas também tinha carga positiva, e no seu interior existiam partículas negativas.
Modelo Atômico de Rutherford: No início do século XX, Ernest Rutherford propôs um novo modelo, em base de novos e mais avançados estudos. Para ele, a maior parte o átomo, era um espaço vazio; no centro, que denominou de núcleo, tinha a maior parte da massa do átomo. No núcleo, tinha cargas positivas, e os electrões (partículas) giram em torno do núcleo, como os planetas giram em torno do sol.
Isso tudo, todas essas pesquisas, são importantes para nós por que TUDO, hoje, é formado por átomos, por isso é melhor compreendermos mais eles.
1)R: Porcausa das diferenças tipos de sais..
2)R: Sim pelo fato dos fabricantes de foquetes usarem, diversos sais misturados com a polvora, e por isso ocorre as explosões coloridas nos fogos de artifícios..
3)R: Primeiro modelo atomico de Dalnton ''toda matéria é composta por minusculas particulas chamadas átomos''
''os átomos de um determinado elemento são identicos em massa e apresentam as mesmas propriedades quimícas''..
Modelo atomico de Thonson: o modelo de Thonson ficou conhecido como '' pudim de passas'' , o átomo seria um aclomerado composto de uma parte de particulas pessadas (prótons) e de particulas negativas (elétrons),mais leves..
Modelo átomico de Rutherford: conhecido como o modelo do sistema solar.
Modelo atomico de Rutherford boh ''o átomo pode ser representado de forma que as órbitas permitidas para os elétrons tenham relações com os difererentes niveis de energia e, ainda, com as respectivas raiais no esprectorcaracteristicas de cada elemento quimíco''
os modelos átomicos server para nós entendermos melhor as coisas que nós temos em nosso meio pelo fato de tudo ser formado por atomos.
1 ano 3.
alunos: Alisson, Giseli e Jucilene.
01- A origem das cores geradas pela presença de metais nas chamas esta na estrutura eletronica dos átomos. Com a energia liberada na combustão, os elétrons externos dos átomos de metais são promovidos a estados excitados e, ao retornarem ao seu estado eletronico inicial, liberam a energia excedente na forma de luz. A cor ( ou os comprimentos da onda) da luz emitida depende da estrutura eletronica do átomo, desta forma o teste de chamas tem por objetivo a observação da presença de alguns íons metálicos, baseado no espectro de emissão característico para cada elemento.
02-Não, porque os fogos de artificio utilizam deste fenomeno e desta variedade, uma vez que há fogos das mais diversas cores. No entanto, nos fogos de artificio são utilizados sais destes elementos químicos; pois o elemento puro é muitas vezes reativo. E as chamas depende do elemento queimado. Ex: Sais.
03-
- Modelo atomico de Demócrito (450 a.C);
-Modelo atomico de Dalton (1808);
-Modelo atomico de Thomson (1807);
-Modelo atomico de Rutherford (1911);
-Modelo atomico de Bohr (1913);
-Modelo atomico de Sommerfeld (1916);
-Modelo atomico de Schrodinger (1926);
-Evolução do modelo de átomo atual (2008).
1-A coloração do fogo varia de acordo com a mudança do combustível porque a cor do fogo é resultado da cor da luz que emite , e que por sua vez , é formada por fótons partículas muito pequenas que se comportam como uma onda eletromagnética ) dependendo do comprimento da onda eletromagnéticaa a chama terá uma coloração diferente e quanto maior a temperatura ,mais curta é a onda.
2- As cores das chamas produzidas são produzidas a parir de dois fenômenos ,a incadescência e a luminescência .
A incandescência é a luz produzida pelo aquecimento de substancias,por exemplo os metais que são usados nos fogos artificio ,como o aluminio e magnésio , que ao queimarem produzem alta claridade .
A luminescência é a luz produzida a partir da emissão de energia, na forma de luz, por um elétron excitado, que volta para o nível de energia menos energética de um átomo , e as cores são caracteristica de cada sais .
3- Jhon Dalton ,Rutherford, Thomson, Niels Bohr. A importância é que seria impossível manter a qualidade de vida da humanidade com alimentos ,segurança ambiental ,longevidade e conforto, é muito importante.
1-Porque a cor do fogo depende da temperatura em que ele queima e, geralmente, cada parte da chama tem uma temperatura diferente. A cor do fogo, na verdade, é resultado da cor da luz que ele emite. Essa luz é formada por fótons, partículas muito pequenas que se comportam como uma onda eletromagnética. Dependendo do comprimento dessa onda, ela terá uma coloração diferente. O tamanho da onda, por sua vez, depende da quantidade de energia que ela carrega: quanto mais energia, mais curta é a onda. As ondas "menores" são azuis, enquanto ondas "maiores" são vermelhas. A base da chama de uma vela, por exemplo, tem muito calor e forma ondas de luz com muita energia, mais curtas e mais azuladas. A parte alta tem menos calor, portanto forma ondas com menos energia, mais longas e mais avermelhadas.
2-Isso é explicado por meio do modelo atômico de Rutherford-Böhr. Segundo este modelo atômico, em um átomo existem apenas algumas órbitas circulares onde os elétrons permanecem, sendo que cada uma tem seu respectivo número de energia. Quando um elétron permanece em sua determinada órbita, diz-se que está em seu estado fundamental. Se ele passar para uma órbita mais externa, com maior nível de energia, tal elétron se encontrará em seu estado excitado ou ativado.
Porém, para que um elétron passe para um nível maior de energia ele precisa absorver um fóton (quantum de energia) de algum meio externo, como o calor do fogo, por exemplo. Nos fogos de artifício há um pavio que, ao ser acendido, inicia a combustão, fornecendo assim energia para os átomos de determinado elemento químico. Desse modo, o elétron “salta” de um nível de menor energia para um de nível superior.
Entretanto, o estado fundamental é mais estável que o excitado, por isso, imediatamente este elétron retorna para a órbita anterior. Mas, para isso, ele precisa perder a energia que ganhou; e ele faz isso emitindo certa quantidade de energia radiante, sob forma de um fóton de comprimento de onda específico, relacionado com uma determinada cor.Por isso, cada elemento químico emitirá uma cor característica. Desse modo, se for utilizado, por exemplo, oxalato de estrôncio (SrC2O4) ou nitrato de estrôncio ((Sr(NO3)2), será fornecido o íon Sr2+ e dará a cor vermelha; ou se for usado cloreto ou nitrato de cobre (CuCl2 e NH4Cu(NO3)3 ), será produzido o íns Cu2+ e fornecerá a cor verde ou azul.
1.Porque a cor do fogo depende da temperatura em que ele queima e, geralmente, cada parte da chama tem uma temperatura diferente. A cor do fogo, na verdade, é resultado da cor da luz que ele emite. Essa luz é formada por fótons, partículas muito pequenas que se comportam como uma onda eletromagnética. Dependendo do comprimento dessa onda, ela terá uma coloração diferente. O tamanho da onda, por sua vez, depende da quantidade de energia que ela carrega: quanto mais energia, mais curta é a onda. As ondas "menores" são azuis, enquanto ondas "maiores" são vermelhas. A base da chama de uma vela, por exemplo, tem muito calor e forma ondas de luz com muita energia, mais curtas e mais azuladas. A parte alta tem menos calor, portanto forma ondas com menos energia, mais longas e mais avermelhadas. Alguns combustíveis específicos podem acrescentar novas cores às chamas. Quando o interior do seu fogão está sujo, por exemplo, o fogo dele pode ficar verde por causa da sujeira, o que pode ser perigoso. Já o metanol, combustível usado pelas equipes da Fórmula Indy, tem uma chama invisível. Para poder combater os eventuais incêndios nos boxes, as equipes acrescentam algumas impurezas no combustível, que deixa de ser incolor.
2.Os fogos de artifício deixam milhões de pessoas impressionadas graças às suas lindas cores brilhantes. Este efeito se deve à queima de diferentes elementos químicos. Cada íon existente na composição das substâncias utilizadas ou formadas na combustão da pólvora emite uma luz com uma cor característica, quando submetidos à ação de uma chama. Isso é explicado por meio do modelo atômico de Rutherford-Böhr. Segundo este modelo atômico, em um átomo existem apenas algumas órbitas circulares onde os elétrons permanecem, sendo que cada uma tem seu respectivo número de energia. Quando um elétron permanece em sua determinada órbita, diz-se que está em seu estado fundamental. Se ele passar para uma órbita mais externa, com maior nível de energia, tal elétron se encontrará em seu estado excitado ou ativado.
3.Nem sempre o homem pensou que o átomo é como o conheces atualmente. Foi uma ideia que evoluiu ao longo dos anos. Apesar do primeiro modelo atómico ter sido apresentado já no séc. XIX, a ideia de que a matéria é feita de pequeníssimos corpúsculos surgiu há muito, muito tempo.A estrutura da matéria foi objeto de análise e reflexão desde os primórdios da civilização moderna, a palavra átomo vem da palavra grega de som igual e que significava indivisível. Ou seja, a unidade mínima da matéria, massa ou como disseram os gregos.
O significado atual de átomo provém da sua evolução do século XIX, e no século passado descobriu-se que tinha partículas subatômicas e começou-se a elaborar a estrutura do átomo atual ou inter-relação dos tipos de partículas elementares mais pequenas que o compõem.
Antes de expor o modelo de átomo atual proposto pela Mecânica Global, dada a importância que tem a evolução dos diferentes modelos atômicos desenvolvidos, vamos comentar muito brevemente a história do átomo por ordem cronológica.
No século V a.C., o filósofo grego Leucipo e seu discípulo Demócrito imaginaram a matéria como sendo constituída por pequenas partículas indivisíveis - os átomos, como lhes chamaram. Concluíram que a matéria não poderia ser infinitamente divisível. Se a partíssemos variadas vezes, chegaríamos a uma partícula muito pequena, indivisível e impenetrável a que se denominou átomo.
Esta é uma palavra de origem grega que deriva de "a + thomos" , que significa "sem divisão".
Esta ideia de que os átomos seriam pequenas partículas indivisíveis perdurou durante mais de vinte séculos
1- O teste de chama é baseado no fato de que quando uma certa quantidade de energia é fornecida a um determinado elemento químico (no caso da chama, energia em forma de calor), alguns elétrons da última camada de valência absorvem esta energia passando para um nível de energia mais elevado, produzindo o que chamamos de estado excitado. Quando um desses elétrons excitados retorna ao estado fundamental, ele libera a energia recebida anteriormente em forma de radiaçao. Cada elemento libera a radiação em um comprimento de onda característico, pois a quantidade de energia necessária para excitar um elétron é única para cada elemento. A radiação liberada por alguns elementos possui comprimento de onda na faixa do espectrovisível, ou seja, o olho humano é capaz de enxergá-las através de cores. Assim, é possível identificar a presença de certos elementos devido à cor característica que eles emitem quando aquecidos numa chama.
2- Geralmente são utilizados sais de potássio, mas não de sódio, isso é devido ao fato dos sais de sódio absorverem água da atmosfera com maior facilidade do que os sais de potássio. Esse fato é o que impossibilita a utilização de sais de sódio em fogos de artifícios, uma vez que ao serem estocados, caso fossem feitos com sais de sódio, ocorreria a absorção de água, o que atrapalharia no momento da explosão do fogo. Além da intensa luz amarela que é obtida com os sais de sódio, que ofuscaria as outras cores.
3- 450 a .c. - Modelo atômico de Demócrito. 1808 – Modelo atômico de Dalton. 1807 – Modelo atômico Thomson. 1911 – Modelo atômico de Rutherford. 1913 – Modelo atômico de Bohr. 1916 – Modelo atômico de Sommerfeld. 1926 – Modelo de Schrödinger ou modelo atual segundo a Wikipédia. 2008 – Evolução do modelo de átomo atual.
3-Os modelos atômicos são teoria baseadas na experimentação feita por cientistas para explicar como é o átomo.
Os modelos não existem na natureza. São apenas explicações para mostrar o porquê de um fenômeno. Muitos cientistas desenvolveram suas teorias. Com o passar dos tempos, os modelos foram evoluindo até chegar ao modelo atual.
1)O teste de chama é baseado no fato de que quando uma certa quantidade de energia é fornecida a um determinado elemento químico (no caso da chama, energia em forma de calor), alguns elétrons da última camada de valência absorvem esta energia passando para um nível de energia mais elevado, produzindo o que chamamos de estado excitado. Quando um desses elétrons excitados retorna ao estado fundamental, ele libera a energia recebida anteriormente em forma de radiação. Cada elemento libera a radiação em um comprimento de onda característico, pois a quantidade de energia necessária para excitar um elétron é única para cada elemento. A radiação liberada por alguns elementos possui comprimento de onda na faixa do espectrovisível, ou seja, o olho humano é capaz de enxergá-las através de cores. Assim, é possível identificar a presença de certos elementos devido à cor característica que eles emitem quando aquecidos numa chama.
2)Geralmente é utilizado sais de potássio, mas não de sódio, isso é devido ao fato dos sais de sódio absorverem água da atmosfera com maior facilidade do que os sais de potássio. Esse fato é o que impossibilita a utilização de sais de sódio em fogos de artifícios, uma vez que ao serem estocados, caso fossem feitos com sais de sódio, ocorreria a absorção de água, o que atrapalharia no momento da explosão do fogo. Além da intensa luz amarela que é obtida com os sais de sódio, que ofuscaria as outras cores.
3)450 a .c. - Modelo atômico de Demócrito.
1807 – Modelo atômico Thomson.
1911 – Modelo atômico de Rutherford.
1913 – Modelo atômico de Bohr.
1916 – Modelo atômico de Sommerfeld.
1926 – Modelo de Schrödinger ou modelo atual segundo a Wikipédia.
2008 – Evolução do modelo de átomo atual.
1-O teste envolve a introdução da amostra em uma chama e a observação da cor resultante. As amostras geralmente são manuseadas com um fio de platina previamente limpo com ácido clorídrico para retirar resíduos de analitos anteriores
2-fogos de artifício são explosivos dotados de um pavio para iniciar a combustão. A combustão inicial provoca a rápida ascensão do foguete, que a certa altura explode violentamente. Eles são usados em festas populares ou celebrações para criar um efeito ruidoso ao acontecimento, e como meio de aviso de que algum acontecimento está iniciando ou terminando.
3-acreditava-se que dividindo a matéria em pedaços cada vez menores, chegar-se-ia a um ponto onde partículas, cada vez menores, seriam invisíveis ao olho humano e, segundo alguns pensadores, indivisíveis. Graças a essa propriedade, receberam o nome de átomos, termo que significa indivisíveis, em grego. Foi quando surgiu entre os filósofos gregos o termo atomismo.
1) o teste de chama é baseado no fato de que quando uma certa quantidade de energia é fornecida a um determinado elemento químico (do caso da chama,energia em forma de calor),alguns elétrons da ultima camada de Valencia absorve essa energia passando para um nível de energia mais elevado,produzindo o que chamamos de estado hesitado .
a radiação liberada por alguns elementos possui comprimento de onda na faixa do esprectrovisivel, ou seja, o olho humano é capaz de encher-galas a traz de cores assim é possível identificar a presença de certos elementos de vida cor característica que eles emitem quando aquecidos numa chama.
2) as cores produzidas em show de fogos de artifícios sao produzidas a partir de dois fenômenos a incandescência e a luminescência.
continuidade da 2) a cor basicamente da chama depende basicamente do elemento químico em maior abundância no material que esta sendo queimado ou seja elas nao tem relação nem uma pois sao feitas de produtos químicos totalmente diferentes.
3) o modelo de dalton , o modelo de trompson , modelo de rutherford=-bohr, modelo de sommerfeld, modelo dos orbitas e o principio da incerteza de. hesenberg,
1)O teste de chama ou prova da chama é um procedimento utilizado em Química para detectar a presença de alguns íons metálicos, baseado no espectro de emissão característico para cada elemento.O teste de chama apenas fornece informação qualitativa. Dados quantitativos, sobre a proporção dos elementos na amostra, podem ser obtidos por técnicas relacionadas a fotometria de chama ou espectroscopia de emissão.
2)Os fogos de artifício deixam milhões de pessoas impressionadas graças às suas lindas cores brilhantes. Este efeito se deve à queima de diferentes elementos químicos. Cada íon existente na composição das substâncias utilizadas ou formadas na combustão da pólvora emite uma luz com uma cor característica (conforme pode se ver na tabela 1), quando submetidos à ação de uma chama.
Alunos: Amanda e Mayron
Série: 1º ano1
Questão 01: O fogo muda sua cor dependendo do elemento acrescentado pois muda o comprimento das ondas dos fótons, dependendo do comprimento dessa onda, a chama tem uma coloração diferente. Essa onda tem o tamanho alterado dependendo da carga que ela carrega. Quanto mais energia, mais curta é a onda. As ondas menores são azuis, as maiores são vermelhas.
Alunos: Eduarda e Alessandro
série: 1° ano 1
questão 01: O fogo muda sua cor dependendo do elemento acrescentado pois muda o comprimento das ondas dos fótons, dependendo do comprimento dessa onda, a chama tem uma coloração diferente. Essa onda tem o tamanho alterado dependendo da carga que ela carrega. Quando mais energia, mais curta é a onda. As ondas menores são azuis, as maiores são vermelhas.
Nomes: Adriano,Camila,Mariana
-continuação
3) Modelo atômico de Dalton, de Thomson, de Rutherford, de Bohr.
A pesquisa é importante no nosso cotidiano porque com ela adquirimos conhecimento nos deixando mais informados através de novas tecnologias para compreendermos o passado e melhorar o presente.
Questão 2: Existe sim uma relação diferente, a cada elemento químico possui órbitas com níveis de energia com valores diferenciados, cada energia emitida será diferente para cada um. Por isso, cada elemento químico emitirá uma característica de cor diferente.
Alunos: Amanda e Mayron
Série:1°ano1
Questão 02: Sim, pois este efeito se deve a queima de diferentes elementos químicos.Cada íon existe na composição das substâncias utilizadas ou formadas na combustão da pólvora emitindo uma luz com uma cor característica, quando submetidas a ação de uma chama.
Questão 3:
Os principais são: o modelo de Dalton, modelo de Thompson, modelo de Rutherford - Bohr, modelo de Sommerfeld e o de Heisenberg.
É de extrema importância para um futuro profissional de química o conhecimento dos modelos atômicos criados pelo homem no decorrer da história da química para podermos compreender a evolução desta ciência com melhor clareza e profundidade, pois para Bosquilha (2003) "toda a história da química esta baseada no âtomo".
Alunos: Eduarda e Alessandro
Série: 1° ano 1
Questão 2: Sim, pois este efeito se deve a queima de diferentes elementos químicos. Cada íon existe na composição das substâncias utilizadas ou formadas na combustão da pólvora, emitindo uma luz com uma cor característica quando submetidas a ação de uma luz.
1 - A cor do fogo, é a cor da luz que ele emite. Aluz é formada por fótons, partículas, bem pequenas. O comprimento da onda eletromagnética. Cada onde tem um certo comprimento, e um certa coloração diferente, Se a onda tiver com muita energia. Mais curta é a onda. As ondas menos são azuis, e as maiores são vermelhas, e o metanol (combustível) é incolor, por motivos de impurezas no combustível.
2 - A explosão dos fogos de artifício fica colorida, pois os fabricantes adicionam alguns produtos que ao reagirem com o calor mudam de cor, assim como a experiência feita em sala.
3 - Modelo Atômico de Dalton, Modelo Atômico de Thomson, Modelo Atômico de Rutherford. A importância é a escola, o conhecimento para mais no futuro ajudar em alguma profissão desejada,
450 a .c. - Modelo atômico de Demócrito.
1808 – Modelo atômico de Dalton.
1807 – Modelo atômico Thomson.
1911 – Modelo atômico de Rutherford.
1913 – Modelo atômico de Bohr.
1916 – Modelo atômico de Sommerfeld.
1926 – Modelo de Schrödinger.
Propõem as nós a refletir os conhecimentos que são transmitidos. Uma pesquisa é muito importante em nosso cotidiano.
Alunos: Amanda e Mayron
Série:1°ano1
Questão 03: O modelo atômico de Dalton foi o primeiro modelo atômico proposto no século XIX, por um cientista chamado John Dalton. Ele caracterizou o átomo como sendo esférico, indivisível, e indestrutível.
O modelo atômico de Thomson , foi o segundo modelo atômico realizado no século XIX , ele conclui que não era apenas uma esfera indivisível. A esfera tinha carga positiva e no seu interior existiam partículas com cargas elétricas negativas.
Modelo atômico de Rutherford, foi o terceiro modele atomico criado no início do século XX, por um cientista chamado Ernest Rutherford, ele propôs que a maior parte do átomo era vazio, na região central do átomo ele chamou de núcleo aonde se concentra a massa total do átomo. O núcleo tem carga positiva e os electrôes giram em torno do núcleo.
Modelo atômico de Bohr foi o quarto modelo atômico proposto por Niels Bohr, que foi criado em 1913, ele conclui que: os electrôes se movem em torno do núcleo com órbitas circulares, a cada órbita corresponde a uma determinada energia.
Demócrito/Leucipo: (teoria atomista; cerca 400 a.C.) Sem comprovação científica. A teoria diz que a matéria é composta por elementos indivisíveis chamados átomos. Não há certeza se a teoria foi concebida por Demócrito ou por seu mestre Leucipo, mas parece não haver dúvidas de ter sido Demócrito quem sistematizou a teoria atomista.
Importância: primeira definição de átomo.
Dalton: (modelo da bola de bilhar; início do século XIX)
Dalton prova cientificamente a existência do átomo, ainda considerado a menor partícula esférica, maciça e indivisível formadora da matéria.
Importância: primeiro modelo atômico experimental.
Thomson: (modelo do pudim de passas ou do bolo de ameixas; final do século XIX) Descobriu partículas negativas, as quais deu o nome de elétrons, e da relação entre a carga e a massa do elétron, antes do descobrimento do próton ou do nêutron. O átomo seria composto de elétrons embebidos uniformemente numa “sopa” de cargas positivas, como as passas num pudim.
Importância: primeiro modelo a derrubar a ideia de indivisibilidade do átomo.
Rutherford: (modelo do sistema solar; início do séxulo XX) O átomo teria um núcleo positivo, que seria muito pequeno em relação ao todo mas teria grande massa e, ao redor deste, os elétrons, que descreveriam órbitas circulares em altas velocidades, para não serem atraídos e caírem sobre o núcleo. A eletrosfera, (local onde se situam os elétrons) seria cerca de dez mil vezes maior do que o núcleo atômico, e entre eles haveria um espaço vazio.
Importância: primeira divisão do átomo em regiões
O dinamarquês Niels Bohr ainda complementaria os estudos de Rutherford propondo a divisão da eletrosfera em níveis e subníveis de energia. Assim, o elétron possuiria energia quantizada e não a perderia espontaneamente, devendo haver algum tipo de excitação para isso, o que o faria “pular” para um subnível mais externo, ou seja, mais distante do núcleo.
3- 450 a .c. - Modelo atômico de Demócrito
1808 – Modelo atômico de Dalton.
1807 – Modelo atômico Thomson
1911 – Modelo atômico de Rutherford
1913 – Modelo atômico de Bohr.
1916 – Modelo atômico de Sommerfeld.
1926 – Modelo de Schrödinger
2008 – Evolução do modelo de átomo atual
Tudo o que nós conhecemos é formado por átomos. Compreender a esrutura atômica nos permitiu conhecer a matéria de que somos formados e aprender a manipular e criar novas tecnologias. A energia nuclear por exemplo, só é possível graças ao conhecimento sobre a estrutura atômica. Na medicina, se vc precisar um exame de ressonância magnética, radioterapia, raio-x e etc, só são possível por causa disso também.
3-450 a .c. - Modelo atômico de Demócrito
1808 – Modelo atômico de Dalton
1807 – Modelo atômico Thomson
1911 – Modelo atômico de Rutherford
1913 – Modelo atômico de Bohr
1916 – Modelo atômico de Sommerfeld
1926 – Modelo de Schrödinger
2008 – Evolução do modelo de átomo atual
Tudo o que nós conhecemos é formado por átomos. Compreender a esrutura atômica nos permitiu conhecer a matéria de que somos formados e aprender a manipular e criar novas tecnologias. A energia nuclear por exemplo, só é possível graças ao conhecimento sobre a estrutura atômica. Na medicina, se vc precisar um exame de ressonância magnética, radioterapia, raio-x e etc, só são possível por causa disso também.
1-as chamadas adquirem cores de acordo com a sua temperatura.O poder calorico do material queimado e que determine a temperatura da chama.As chamas azuis sao as menos quentes
2-sim.Porque ultilizam um fenomeno de variedade com cores diversas entre essas os elementos quimicos pois o elemento e puro,e muitas vezes e reativo tais como o sodio cobreentre outros.
3-Em 1808 o cientista ingles foi Dalton e publicou um livro apresentado sua teoria sobre a contituiçao atomica da materia
1- A composição dos gases que se desprendem, assim como a sua temperatura e disponibilidade do comburente, determinam a cor da chama. No caso da combustão de madeira ou papel a chama é roxa, amarela ou alaranjada. Na queima de gases de hidrocarbonetos obtem-se uma chama azulada, e cores exóticas são obtidas quado são queimadas substâncias que contém elementos metálicos.
2- A incandescência é a luz produzida pelo aquecimento de substâncias. Quando se aquece um metal, por exemplo, ele passa a emitir radiação infravermelha, que vai se modificando até se tornar radiação visível na cor branca. Isso irá depender de qual temperatura é atingida. Um exemplo de incandescência são as lâmpadas incandescentes, onde existe um filamento de tungstênio que é aquecido e passa a produzir luz, a partir da incandescência. Este fenômeno é, também, visto nos fogos de artifício, nos quais são utilizados metais como o alumínio e magnésio, que ao queimarem produzem alta claridade.
A luminescência é a luz produzida a partir emissão de energia, na forma de luz, por um elétron excitado, que volta para o nível de energia menos energético de um átomo.A luminescência é uma característica de cada elemento químico. Ou seja, átomos de sódio quando aquecido, emitem luz amarela, pela luminescência. Já os átomos de estrôncio e lítio produzem luz vermelha. Os de bário produzem luz verde e assim por diante.
3-450 a.C- Modelo atômico de Demócrito
1808-Modelo atômico de Dalton
1807-Modelo atômico de thomsom
1911-Modelo atômico de Rutherford
1913-Modelo atômico de Bahr
1916-Modelo atômico de Sammerfeld
1926-Modelo atômico de Schradinger
2008-Evolução do modelo de átomo atual.
Os modelos atômicos servem por exemplo para saber como aconteceram reações em nós mesmos . Por exemplo nós somos matéria orgânica, nossas células são compostas por moléculas. Se soubermos as propriedades dos átomos dessas moléculas entenderemos alguma problema mas para explicá-las eu precisaria de fazer um estudo aprofundado.
1º 05
2- Sim, pois ambas as reações químicas possuem praticamente as mesmas substâncias que irão dar á cor, pois emitem uma luz com uma cor característica, quando submetidos à ação de uma chama.
3- Os principais modelos atômicos foram o de J.J Thomson em 1897, o de Rutherford em 1911 e Bohr em 1913. A importância é que através das pesquisas podemos ter a confirmação de determinados assuntos, e também ela está ligada ao desenvolvimento da humanidade.
1-as cores das chamas são diferentes pelos componentes químicos que estão entrando em combustão que estão queimando junto com o álcool ,por isso a cor das chamas são diferentes,
2- sim.a cor das chamas dos fogos de artifício são denominadas pelos componentes químicos que estão misturados com a pólvora dentro dos fogos de artifício,
3-eles são importantes para que possa se desenvolver novos produtos baseados nos diferentes modelos atômicos existentes,
existem os modelos atômicos:
1-as cores das chamas são diferentes pelos componentes químicos que estão entrando em combustão que estão queimando junto com o álcool ,por isso a cor das chamas são diferentes,
2- sim.a cor das chamas dos fogos de artifício são denominadas pelos componentes químicos que estão misturados com a pólvora dentro dos fogos de artifício,
3-eles são importantes para que possa se desenvolver novos produtos baseados nos diferentes modelos atômicos existentes,
existem os modelos atômicos:1-as cores das chamas são diferentes pelos componentes químicos que estão entrando em combustão que estão queimando junto com o álcool ,por isso a cor das chamas são diferentes,
2- sim.a cor das chamas dos fogos de artifício são denominadas pelos componentes químicos que estão misturados com a pólvora dentro dos fogos de artifício,
3-eles são importantes para que possa se desenvolver novos produtos baseados nos diferentes modelos atômicos existentes,
existem os modelos atômicos:1-as cores das chamas são diferentes pelos componentes químicos que estão entrando em combustão que estão queimando junto com o álcool ,por isso a cor das chamas são diferentes,
2- sim.a cor das chamas dos fogos de artifício são denominadas pelos componentes químicos que estão misturados com a pólvora dentro dos fogos de artifício,
3-eles são importantes para que possa se desenvolver novos produtos baseados nos diferentes modelos atômicos existentes,
existem os modelos atômicos:
1-as cores das chamas são diferentes pelos componentes químicos que estão entrando em combustão que estão queimando junto com o álcool ,por isso a cor das chamas são diferentes,
2- sim.a cor das chamas dos fogos de artifício são denominadas pelos componentes químicos que estão misturados com a pólvora dentro dos fogos de artifício,
3-eles são importantes para que possa se desenvolver novos produtos baseados nos diferentes modelos atômicos existentes,
existem os modelos atômicos:
1. Porque a cor a cor do fogo depende da temperatura em que ele queima,e geralmente cada parte da chama tem uma temperatura diferente a cor do fogo na verdade é resultado da cor da luz que ele emite.essa luz é formada por fótons,partículas muito pequenas, que se comportam como uma onda eletro magnética. Dependendo do comprimento dessa onda, ela terá uma coloração diferente.
2. Cada ion existente na composição das substâncias formadas ou utilizadas na combustão da polvora entre uma luz com a cor caracterizada ao elemento químico possui órbitas de energia com valores diferentes para cada um, por isso cada elemento químico possuí uma cor caracterizada.
3. Modelo atômico de demócrito: 450 a.C
Modelo atômico de dalton: 1803
Modelo atômico de thomson: 1897
Modelo atômico de rutherfort: 1911
Modelo atômico de bohr: 1913
A importância para um futuro profissional de química, possuir esse conhecimento é evoluir a ciência com melhor profundidade baseado no átomo
Nomes: Gabriela Martins Bononomi e Keyse Wiesner 1°4
1. Porque a cor do fogo depende da temperatura em que ele queima e, geralmente, cada parte da chama tem uma temperatura diferente. A cor do fogo, na verdade, é resultado da cor da luz que ele emite. Essa luz é formada por fótons, partículas muito pequenas que se comportam como uma onda eletromagnética. Dependendo do comprimento dessa onda, ela terá uma coloração diferente.
2. Sim, cada íon existente na composição das substâncias utilizadas ou formadas na combustão da pólvora emite uma luz com uma cor característica , quando submetidos a ação de uma chama. Por exemplo: elemento químico: arsênio, cor característica: azul.
3. Modelo de Demócrito, Modelo de Dalton, Modelo de Thompson, Modelo de Rutherford-Bohr, Modelo de Sommerfeld, Modelo dos Orbitais e o princípio da incerteza de Heisenberg.
É indiscutível a contribuição que a química trouxe para a humanidade através do estudo de átomo, novos materiais e medicamentos foram criados, a qualidade de vida das pessoas foi melhorada e embora existam muitos problemas ainda a serem enfrentados.
1) Quando submetidos ao calor do fogo, eles recebem energia e ao voltarem devolvem esta energia, as cores são variadas pois depende da quantidade de energia maxima que os eletrons podem absorver ao passar de um subnível para o outro.
2) Sim, cada íon existente na composição das substâncias utilizadas ou formada na combustão da Pólvora emite uma luz com uma cor característica quando submetidos à ação de uma chama.
3)Modelo Atômico de Demócrito, Modelo Atômico de Dalton, Modelo Atômico de Thomson, Modelo Atômico de Rutherford, Modelo Atômico de Bohr, Modelo Atômico de Sommerfeld. Através do estudo dos átomos, novas materiais e medicamentos foram criados, a qualidade de vida das pessoas foi melhorada e embora existam problemas ainda a serem enfrentados.
3- MODELO DE DALTON ,THOMPSON, RUTHERFORD, BOHR Os materialistas dizem que a vida, uma vez que é feita de átomos, moléculas e reações químicas, é simplesmente apenas química e nada mais - e que a vida originou-se por reações químicas acidentais.
Nome: ADRIELE TRAPP E JAQUELINE BREIER
1. SÃO DIFERENTES POIS OS COMPONENTES OU CONTAMINENTES TEM DIFERENTES COMPOSTOS POR ISSO NO TESTE DE CHAMAS SÃO DIFERENTES.
2. SIM , PORQUE OS ELEMENTOS DOS FOGOS DE ARTIFÍCIOS UTILIZAM DOS FENÔMENOS DE SAIS DE SÓDIO, SAIS DE COBRE, DE ESTRÔNCIO, BÁRIO , E LÍTIO.
3.MODELO ATÔMICO DE DALTON
MODELO ATÔMICO DE THOMSOM
MODELO ATÔMICO DE RUTHERFORD
MODELO ATÔMICO DE BOHR
MODELO ATÔNICO DE SOMMERFELD
MODELO ATÔMICO DE SCHRÖDINGER.
É IMPORTANTE PARA ENTENDER O QUE SE PASSA NO DIA A DIA .
Mayara A. Ferreira e Gabriela de Macedo- 1° ano 04;
1- Os olhos humanos detectam as diferentes cores devido as diferentes frequências da luz, eles respondem de maneira diferente a cada frequência. Na realidade somente uma porção de frequências de onda são detectadas pela retina humana e as ondas com essas frequências possuem comprimentos de onda entre 400 e 700 nanômetros.
Quando um objeto é aquecido ele emite radiação, que pode ser analisada por sua cor. Esta é uma análise qualificativa, pode se descobrir a faixa de frequência da luz que está sendo emitida pela identificação da cor.
2- O calor liberado torna o material das baladas líquido ou gasoso. Então, as partículas começam a emitir luz, cuja cor dependerá do comprimento da onda. A luz visível são radiações eletromagnéticas que medem entre 380 nanômetros( um bilionésimo de metrô), quando causam a sensação do violeta, a 780 nanômetros, quando provocam a sensação do vermelho.
3- Modelo atômico de Demócrito;
Modelo atômico de Dalton;
Modelo atômico de Thomson;
Modelo atômico de Rutherford;
Modelo atômico de Bohr;
Modelo atômico de Sommerfeld;
Modelo atômico de Schrödinger.
É importante para podermos entender oquê se passa ao nosso redor, no nosso cotidiano,as substâncias que nos formam, que estão dentro de nós, é importante também para podermos entender as doenças, suas causas, curas e tratamentos, etc.
wesley Pablo e Wellington Lamin 1 ano 4
1 Vai depender do elemento quimico que esta em alta combustao ai com o calor os elementos formao cores diferentes.
2 existe porque nos fogos de artificios tambem sao queimados elementos como metais e sais
3 o modelo de Dalton,Thonson e Rutherdford-Bohr
as pesquisas
1º ano 4
1R= A cor depende basicamente do elemento químico em maior abundância no material que esta sendo queimado. Como por exemplo o cobre tem uma cor verde, o potássio violeta etc.
2R= Sim. A cor dos fogos de artificios se deve a queima de diferentes elementos químicos. Cada íon existente na composição das substâncias utilizadas ou formadas na combustão da pólvora emite uma cor que se dá o elemento químico.
3R= O modelo de Dalton, o modelo de Thompson, o modelo de Rutherford-Bohr, o modelo de Sommerfeld e o modelo de Heisenberg. A pesquisa da há nós a oportunidade de desenvolver a nossa autonomia na construção da nossa aprendizagam e buscar novos conhecimentos.
Alunos:Sávio W. Schutz,Tafarel Horstman e Deivit Roling
1° série 1
1: As cores das chamas são diferentes por que os sais tem composição química difentes uns dos outro , e também pela diferença de cor e testura das subtancias.
2:Sim.As cores dos fogos de artificio são diferentes justamente por que vários tipos de elementos químicos são utilizados, como vimos no experimento a cor da chama depende da substância que é queimada...
3:Os principais modelos atomicos são o de Dalton, de Thomson,de Rutherford,de Bohr, de Democrito e o Modelo Atual.As pesquisas são muito importantes por que atravez dela aprimoramos o nosso conhecimento ,sabemos cada vez mais.
1) vai depender do elemento químico que está em alta combustão ai com o calor os elementos formam cores diferentes.
2)Para deixar os fogos coloridos, os fabricantes misturam á pólvora sais de diferentes elementos para que quando detonado, produzam cores diferentes.
3)Durante muito tempo pensava-se que os átomos tinham forma esférica e que eram indivisíveis. No século XIX, um cientista chamado John Dalton propôs um modelo de representação do átomo com base nas ideias da altura.
1- Etanol.
2- A relação é que nas bebidas álcoolicas é posto umas substância chamada álcool etílico popularmente conhecido como etanol.
Respostas:
n°1: As cores diferenciadas dependem basicamente do elemento químico que se encontra em maior abundância no material que está sendo queimado, como são ali, seis diferentes elementos químicos, estes apresentam seis cores distintas e de características diferentes.
n°2: Sim,pois existem vários elementos químicos diferentes no material queimado dos fogos de artifício. Cada íon presente na composição das substâncias formadas da pólvora em combustão emite luz de cores características.
n°3: Modelo Atômico de Dalton: pensava-se que os átomos tinham forma esférica e que eram indivisíveis, Dalton pensava a altura e dizia que o átomo era esférico, indivisível e indestrutível.
Modelo Atômico de Thomsom: Thomson concluiu que o átomo não era apenas uma esfera indivisível como tinha dito Dalton. Esta esfera tinha carga positiva e no seu interior existiam partículas com carga eléctrica negativa, a que se dá o nome de elétrons.
Modelo Atômico de Rutherford: Ele concluiu que, a maior parte do átomo era espaço vazio; na região central do átomo, a que chamou núcleo, concentra-se toda a massa do átomo; o núcleo tem carga positiva; os elétrons giram em torno do núcleo, tal como os planetas em torno do Sol.
Modelo Atômico de Bohr: Bohr concluiu que, os elétrons se movem em torno do núcleo com órbitas circulares; a cada órbita corresponde uma determinada energia; os elétrons com mais energia movem-se em órbitas mais afastadas do núcleo.
Modelo da Nuvem Eletrônica: Este modelo diz que,a zona central do átomo, a que se dá o nome de núcleo, é constituída por prótons (partículas com carga positiva) e nêutrons (partículas com carga neutra);à volta do núcleo do átomo giram os elétrons; os elétrons não têm órbitas bem definidas, possuem antes movimentos aleatórios em torno do núcleo do átomo; na nuvem eletrônica, há elétrons que se encontram preferencialmente mais próximos do núcleo e outros que se encontram preferencialmente mais afastados; o núcleo é muito pequeno quando comparado com o tamanho da nuvem eletrônica. É possível por isso concluir que a maior parte do átomo é espaço vazio.
1- A imagem mostra cores diferentes de fogo porque os comburentes são substâncias distintas, são sais de metais como o potássio, o estrôncio, o sódio e etc, que o serem queimados produzem chamas de cores diferentes através da luminescência.
2- Sim, porque os fogos são coloridos através da luminescência de cada metal. Eles usam deste fenômeno e desta variedade uma vez que existem fogos das mais diversas cores, No entanto, nos fogos de artifício são utilizados sais deste elementos s pois o elemento puro é muitas vezes reativo.
3- No século V a.C o filosofo grego Leucipo e seu discípulo Demócrito imaginaram a matéria sendo constituída por pequenas partículas, o átomos.
Dentre vários modelos atômicos já existentes, temos:
O modelo de Dalton, no seu modelo ele concluiu que, os átomos que pertencem a elementos químicos diferentes apresentam massas diferentes, assim como diferentes propriedades. Que os compostos são associações de átomos de diferentes elementos. E que, as reações químicas podem ser explicadas com base no rearranjo dos átomos.
O modelo de Thomson, nesta descobriu partícula negativas ainda mais pequenas que os átomos, os elétrons, provando então que os átomos não eram indivisíveis.
O modelo de Rutherford, mais tarde demonstrou que a maior parte do átomo era espaço vazio e descobriu a carga positiva no núcleo, os prótons.
O modelo de Bohr, apresentando poucas alterações no modelo de Rutherford, falando sobre os elétrons e suas órbitas.
E o modelo da nuvem eletrônica, proposta de Heisenberg, Schrödinger e Dirac. Neste modelo diz-se que, no centro estão os prótons e os nêutrons, enquanto os elétrons giram ao seu redor.
A importância destas pesquisas no nosso cotidiano, é servir para cada vez chegarmos mais perto da realidade da formação, criação e existência de tudo e todos, desde pequenas partículas até a maior das estruturas.
1° R:A cor depende basicamente do elemento químico em maior abundancia no material que esta sendo queimado.
2°R:Na hora em que a pólvora é queimada explode a energia produzida excita os elétrons dos átomos desses elementos e dependendo de cada elemento colocado uma cor diferente sairá do fogo de artificio.
3°R:modelo atômico de Danton.
modelo atômico de thomson.
modelo atômico de ruthenford.
modelo atômico de bohr.
modelo de nuvem elétrica.
E a importância dessas pesquisa são boas assim sabemos como funcionam, se desenvolve, e sua partes principais.
Alunos: Amanda e Mayron
Série: 1 ano 1
Continuação da terceira questão: O último modelo e também o atual é o da nuvem eletrônica.Num átomo, o número de prótons é igual ao número de electrões. O número de nêutrons é o que não é precisamente igual. Segundo o modelo atômico atual: O átomo possui um núcleo central de dimensões muitíssimo reduzidas. No núcleo do átomo encontram-se os prótons e os neutrões. Os electrões encontram-se á volta do núcleo, na nuvem eletrônica.
.Qual a importância das pesquisas para nosso cotidiano?
R: Muito importante pois é através delas que descobrimos coisas importantes e de auto ajuda para o nosso dia a dia.
Alunos: Emanuele, Gabriel e Ana 1° 3 EM
1. As cores são diferentes, por que cada íon emite uma cor diferente. Quando sujeitos a elevadas temperaturas, veem os seus íons metálicos (os cátions) que os constituem passarem do estado fundamental a estados excitados, com posterior emissão de radiações de cor característica, sob a forma de uma chama colorida.
2. Sim tem toda relação exemplo Cada íon existente na composição das substâncias utilizadas ou formadas na combustão da pólvora emite uma luz com uma cor característica quando submetidos à ação de uma chama.
3. 450 a.c Modelo atômico de Demócrito
1807 Modelo atômico de Dalton
1808 Modelo atômico de Thomson
1911 Modelo atômico de Rutherford
1913 Modelo atômico de Bohr
1916 Modelo atômico de Sommerfeld
1926 Modelo atômico de Schrodinger
2008 Modelo (atualizado) de Schrodinger.
É de extrema importância para um futuro profissional de química o conhecimento dos modelos atômicos criados pelo homem no decorrer da história da química para podermos compreender a evolução desta ciência
Com melhor clareza e profundidade, É indiscutível a contribuição que a química trouxe para a humanidade através do estudo do átomo, novos materiais e medicamentos foram criados, a qualidade de vidas das pessoas foi melhorada.
Emanuele, Gabriel e Ana 1° 3 EM continuação
1º) Modelo atômico de Dalton (“modelo da bola de gude”)
O primeiro cientista que retomou essa teoria de Demócrito e Leucipo foi John Dalton (1766-1844), no ano de 1803. Baseado em experiências e nas leis ponderais de Proust (Lei das proporções constantes) e de Lavoisier (Lei de conservação das massas), ele formulou o primeiro modelo* atômico, que dizia sucintamente o seguinte:
“Toda matéria é formada por átomos, que são partículas maciças, esféricas e indivisíveis, e um átomo de um elemento se diferencia do outro somente pela mudança nos tamanhos e nas massas.”
2º) Modelo atômico de Thomson (“modelo do pudim de passas”)
Com o estudo das características elétricas da matéria, J.J.Thomson (1856-1940) realizou em 1887 um experimento com um feixe de raios catódicos e descobriu partículas negativas que eram atraídas pelo polo positivo de um campo elétrico externo.
Dessa forma, ele concluiu que o átomo deveria conter uma partícula subatômica negativa, denominada de elétron. Assim, caiu por terra a teoria de Dalton de que o átomo seria indivisível. Seu modelo atômico foi o seguinte:
“O átomo é uma esfera de carga elétrica positiva, não maciça, incrustada de elétrons (negativos), de modo que sua carga elétrica total é nula”.
3º) Modelo atômico de Rutherford (“modelo do sistema solar”)
Com a descoberta da radioatividade, as pesquisas sobre a constituição da matéria puderam ser mais exploradas. Enerst Rutherford (1871-1937) realizou em 1911 um experimento com partículas alfa (α), no qual tentou verificar se os átomos realmente eram maciços. Ao final do experimento, os resultados obtidos mostraram que o átomo contém imensos espaços vazios e um núcleo positivo, onde ficavam os prótons (partículas subatômicas positivas). Portanto, o modelo de Rutherford é enunciado assim:
“O átomo é constituído de duas regiões distintas: um núcleo ou região central que contém praticamente toda a massa do átomo e apresenta carga positiva; e uma eletrosfera, isto é, uma região ao redor do núcleo, onde os elétrons giram em órbitas circulares”.
Com a descoberta da terceira partícula subatômica, o modelo de Rutherford passou a incluir os nêutrons (partículas sem carga elétrica) no núcleo.
4º) Modelo atômico de Rutherford-Böhr
Se o átomo fosse como Rutherford propunha, os elétrons adquiririam um movimento em espiral e colidiriam com as partículas positivas do núcleo, além disso, eles perderiam energia em forma de radiação. Assim, em 1913 foi criado um novo modelo atômico pelo Químico Niels Böhr (1885-1962), que, apesar de revolucionário, mantinha as principais características do modelo de Rutherford. De maneira que este modelo passou a ser chamado de modelo atômico de Rutherford-Böhr e enunciava:
“O átomo pode ser representado de forma que as órbitas permitidas para os elétrons tenham relação com os diferentes níveis de energia e, ainda, com as respectivas raias presentes no espectro característico de cada elemento químico.”
Desse modo, cada órbita circular permitida para os elétrons possuem energias diferentes, constantes e determinadas; sendo denominadas de níveis de energia.
Aluna: Vanessa Eduarda da Cunha. Série: 1° Ano I.
Professor: Diego Fabiano Marcon.
Avaliação de Química.
1- Cada cor é diferente, por que sais de diferentes elementos são misturados para que as cores sejam diferentes. este efeito deve-se a queimada de diferentes elementos químicos. Cada íon existente na composição das substancias utilizadas emite luz com uma cor e característica diferente quando submetidos á ação de uma chama.
2- Não, Para deixar os fogos de artifício coloridos, os fabricantes misturam à pólvora sais de diferentes elementos para que, quando detonados, produzam cores diferentes.
Vejamos alguns dos compostos responsáveis pela coloração dos fogos:
Laranja: os sais de cálcio são responsáveis por esta coloração em foguetes.
Vermelho: a cor rubra surge da queima de sais de Estrôncio ou carbonato de Lítio.
Amarelo: obtido pela queima de Sódio.
Prata: o espetáculo da “chuva de Prata” é produzido pela queima de pó de titânio, de alumínio ou magnésio.
Dourado: o metal ferro presente nos fogos de artifício confere o tom de Ouro.
Azul: o aquecimento do metal cobre nos faz visualizar a cor azul.
Roxo: a mistura de Estrôncio e Cobre dá origem a essa bela cor.
Verde: a queima de Bário faz surgir o verde incandescente.
3- Os principais modelos atômicos durante os séculos de pesquisa foram: Em 1913, Niels Bohr propôs um modelo atômico, mais completo, O modelo de Bohr representa os níveis de energia. Cada elétron possui a sua energia.Modelo Atômico de Dalton,Modelo Atômico de Thomson, Modelo Atômico de Rutherford, Modelo da Nuvem Electrónica.
Foi muito importante sabermos de que o átomo é constituído, o que tem dentro de um átomo, aonde o átomo está presente.
Postar um comentário